- java实体中返回前端的double类型四舍五入(格式化)
婲落ヽ紅顏誶
java
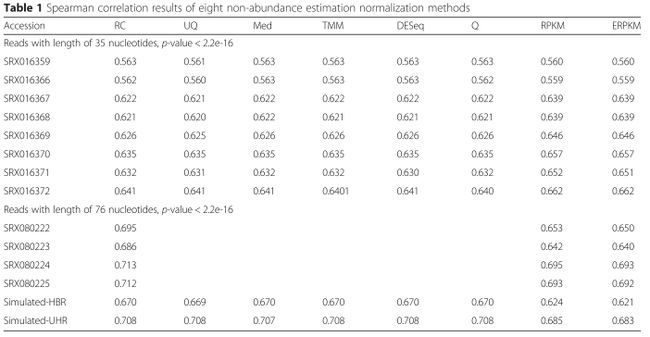
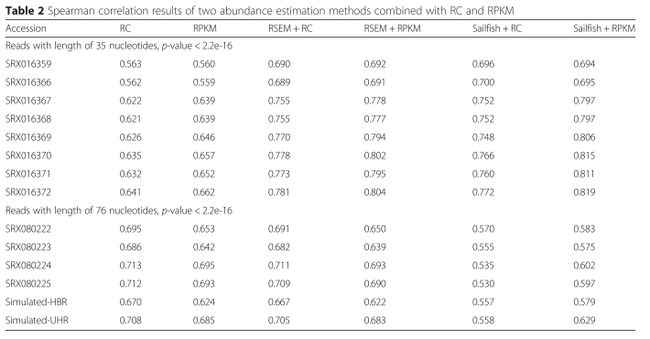
根据业务,需要通过后端给前端返回部分double类型的数值,一般需要保留两位小数,使用jackson转换对象packagecom.ruoyi.common.core.config;importcom.fasterxml.jackson.core.JsonGenerator;importcom.fasterxml.jackson.databind.JsonSerializer;importcom.f
- Django forms组件
在飞行-米龙
Djangodjangopython后端
【一】引入【1】实现登陆验证功能(1)需求分析登陆验证需要前后端交互,采用form表单提交数据对数据进行校验用户名必须以英文大写字母开头密码必须大于三位数反馈给用户错误的信息除了反馈错误的信息还有保留原始输入内容(2)后端代码使用user_info_dict字典每次刷新存储存储前端发送的信息存储后端进行验证的信息defhome(request):#每次后刷新这个信息字典user_info_dict
- Webpack构建优化——区分环境
oWSQo
为什么需要区分环境在开发网页的时候,一般都会有多套运行环境,例如:在开发过程中方便开发调试的环境。发布到线上给用户使用的运行环境。这两套不同的环境虽然都是由同一套源代码编译而来,但是代码内容却不一样,差异包括:线上代码被特殊压缩过。开发用的代码包含一些用于提示开发者的提示日志,这些日志普通用户不可能去看它。开发用的代码所连接的后端数据接口地址也可能和线上环境不同,因为要避免开发过程中造成对线上数据
- Web前端Html的表单
任家伟
前端html
表单的关键字:form标签表示一个表单区域action=“后端地址”method=“提交数据方式:get/post”input单行输入框type=“text”文本name=“定义名称名字自定义”向后端提交的键readonly=“readonly”只读,不可修改,但是可以提交disabled=“disabled”禁用组件不可修改,不能提交type=“password”密码框type=“radio”单
- 程序员开发技术整理
laizhixue
学习前端框架
前端技术:vue-前端框架element-前端框架bootstrap-前端框架echarts-图标组件C#后端技术:webservice:soap架构:简单的通信协议,用于服务通信ORM框架:对象关系映射,如EF:对象实体模型,是ado.net中的应用技术soap服务通讯:xml通讯ado.net:OAuth2:登录授权认证:Token认证:JWT:jsonwebtokenJava后端技术:便捷工
- 日精进
石淑萍
【早上好#淑萍#20230605日精进335】分享嘉宾:海明教练社群运营架构专家全域流量孵化教练个人品牌超千万利润打造高手基本的创业者,对于商业模式的设计都是有漏洞的。股权架构今天我们讲的商业模式主要是盈利模式。很多社群运营会做裂变,不会做转化,因为没有后端的设计。不断的去积累,思考有哪些模式,需要去如何设计。政策领域:政府补贴➕大学生技术/大学生创业团队盈利模型——赋能板块核心一:长期锁客—资格
- 基于SSM+Vue企业销售培训系统 企业人才培训系统 企业课程培训管理系统 企业文化培训班系统Java
计算机程序老哥
作者主页:计算机毕业设计老哥有问题可以主页问我一、开发介绍1.1开发环境开发语言:Java数据库:MySQL系统架构:B/S后端:SSM(Spring+SpringMVC+Mybatis)前端:Vue工具:IDEA或者Eclipse,JDK1.8,Maven二、系统介绍2.1图片展示注册登录页面:登陆.png前端页面功能:首页、培训班、在线学习、企业文化、交流论坛、试卷列表、系统公告、留言反馈、个
- Vue 发送Ajax请求多种方式
Red丶哞
前端vue.jsajax前端
1.发送ajax请求的方式方案一:jq的ajax(在vue中不推荐同时使用)方案二:js原始官方fetch方法方案三:axios第三方2.方案一后端视图函数fromrest_framework.viewsetsimportViewSetfromrest_framework.responseimportResponseclassIndex(ViewSet):defindex(self,request
- haproxy的无缝热重启的实现原理
码农心语
高性能c++开发LINUXhaproxyseamlessreload无缝热重启
目录1.引言2.HAPROXY的准无缝热加载方案3.支持零宕机时间、零延迟的热加载方案3.1multibinder的实现3.2HAProxy启动脚本包装器的实现1.引言 在构建高可用的负载均衡架构时,HAProxy(HighAvailabilityProxy)作为一种可靠而强大的解决方案,被广泛应用于各种网络服务负载均衡环境中。HAProxy通过分发请求到多个后端服务器,实现了负载均衡和故障恢复
- mineadmin使用docker启动方式
qq_38812523
dockerphp容器
找个目录,git下来mineadmin代码,在根目录,创建文件名docker-compose.yml然后复制下面代码version:'3'services:#首先下载前端,https://gitee.com/mineadmin/mineadmin-vue#在后端根目录建立mine-ui目录,把前端文件复制过来。#容器内访问宿主机的地址用:host.docker.internal#宿主机也可以在ho
- js封装SDK 在VUE、小程序、公众号直接调用js调用后端接口(本文以vue项目为例)
祝你今天也快乐
jsvuejavascriptvue.js小程序
1.封装一个js文件msgSdk.js注意:需要修改这个请求地址apiServiceAddress;(function(){if(window.msgSdk){return}varmsgSdk=(function(){varm_msgSdk=thisvarapiServiceAddress="http://172.12.14.5:8000"this.I_SendHTTPRequest=functi
- 接口测试之测试原则、测试用例、测试流程......
程序员老鹰
测试工具功能测试测试用例测试覆盖率系统安全
一、接口的介绍软件测试中,常说的接口有两种:图形用户接口(GUI,人与程序的接口)、应用程序编程接口(API)。接口(API)是系统与系统之间,模块与模块之间或者服务与服务之间相互调用的入口。它的本质:其实就是一种约定,在开发前期,我们约定接口会接收什么数据;在处理完成后,它又会返回什么数据。开发岗位分为前端和后端,他们相互配合完成工作,会协商接口的定义方法。一般后端定义接口,前端调用接口。前后端
- @llvm.amdgcn.workitem.id.x()引发的一些前后端的调研
jc小小川+幻幻融hr
小小川编译器elasticsearch大数据搜索引擎
记录资料:UserGuideforAMDGPUBackend—LLVM5documentationintrinsic函数会执行lowerintrinsicspassllvm-project-main/llvm/lib/CodeGen/IntrinsicLowering.cppllvm-project-main/llvm/lib/Target/AMDGPU/AMDGPULowerIntrinsics
- java后端工程师八股文合集
吹林
springcloudeurekajavajava-eespringboot
1、SQL调优的基本步骤如下:确认性能瓶颈:首先要确定数据库中哪些查询是慢的,哪些查询最需要优化。可以通过监控数据库的CPU、磁盘I/O、网络I/O、缓存等指标来确定性能瓶颈。优化查询语句:如果查询语句本身存在问题,例如使用了不必要的子查询、重复的连接操作等,就需要对查询语句进行优化。优化索引:索引是提高查询性能的关键因素之一。可以通过创建、修改、删除索引来优化查询性能。优化数据结构:如果数据库中
- 浅谈前端路由history和hash的理解
怂怂敲代码
前端哈希算法算法
hash和history在前端面试中是很常考的一道题目,可能很多人对于history和hash的理解差异性就是,他们两者的url字段一个没有#号一个有#号,但是有没有想过为什么这样呢,有无#号又有什么差异呢,这篇文章谈一谈我对前端路由history和hash的理解。hash和history都可以用于前后端分离项目,且两者有各自的特点和各自的使用场景。一、前端路由原理1、SPASPA,即单页面应用(
- accessToken
星梦清河
javaspringboot经验分享redis
1、介绍accessToken,通常是用于身份验证和授权的令牌,它可以用于前端和后端,具体使用方式取决于应用程序的架构和需求。前端应用accessToken通常用于向后端API发送请求时进行身份验证和授权。(1)前端应用程序会在用户登录成功后获取accessToken;(2)并将accessToken存储在本地;(3)然后在每次请求API时,将accessToken作为请求头或参数发送给后端;(4
- 面试复盘(北京某小公司)
无所畏惧的man
面经面试职场和发展
北京某小公司一面复盘先和面试官做了自我介绍,然后他问了我的一些基本情况。然后开始问项目问:谈一谈项目中有哪些亮点?我用redis来做验证码的缓存,当用户登录时,刷新得到验证码,验证码会被放到redis当中,key为生成的随机字符串,value即为言验证码内容,在cookie当中也会存储这个字符串,当用户提交表单时,后端会取到cookie的值,然后从reids缓存中根据key取到验证码的值进行判断即
- beego框架基础知识学习笔记
一弓虽
beego框架学习beego学习
网站beegogithub地址:https://github.com/beego/beegobeego中文学习文档:http://beego.gocn.vip/beego/zh/developing/什么是beegobeego是一个快速开发go应用的HTTP框架他可以用来快速开发API、Web及后端服务等各种应用bee工具什么是beebee工具是一个为了协助快速开发beego项目而创建的项目,通过
- vue+elementUI用户修改密码的前端验证
zj_zjk_sjz
vue.js前端elementuijavascript
用户登录后修改密码,密码需要一定的验证规则。旧密码后端验证是否正确;前端验证新密码的规范性,新密码规范为:6-16位,至少含数字/字母/特殊字符中的两种;确认密码只需要验证与新密码是否一致;弹窗结构取消确认form验证规则passRules:{oldPassword:[{required:true,message:'请输入旧密码',trigger:'blur'}],newPassword:[{va
- Ubuntu系统下C语言开发环境搭建与使用教程
洛可可白
后端专栏ubuntuc语言linux
前言欢迎来到我的技术小宇宙!这里不仅是我记录技术点滴的后花园,也是我分享学习心得和项目经验的乐园。无论你是技术小白还是资深大牛,这里总有一些内容能触动你的好奇心。洛可可白:个人主页个人专栏:✅前端技术✅后端技术个人博客:洛可可白博客代码获取:bestwishes0203封面壁纸:洛可可白wallpaper文章目录Ubuntu系统下C语言开发环境搭建与使用教程教程内容0.序言1.准备工作2.安装SS
- 某小厂java后端初面,记录一下
bpmh
Java开发1天1道面试题java面试
好吧,,,,,本人很菜,再接再励吧,继续刷。简单记录一下面试题,未亡羊补牢呗。1.liftjoin;innerjoin;rightjoin的区别2.union和unionall的区别3.like查询会走索引吗?4.主键和索引的区别5.count(*),count(1),count(ID)的区别6.exists了解吗?作用是什么7.线程池了解吗?8.spring创建的bean是单例模式还是多例模式,
- 爆肝五千字!ECMAScript核心概念与现代JavaScript特性全解析
洛可可白
前端专栏ecmascript前端javascript
前言欢迎来到我的技术小宇宙!这里不仅是我记录技术点滴的后花园,也是我分享学习心得和项目经验的乐园。无论你是技术小白还是资深大牛,这里总有一些内容能触动你的好奇心。洛可可白:个人主页个人专栏:✅前端技术✅后端技术个人博客:洛可可白博客代码获取:bestwishes0203封面壁纸:洛可可白wallpaper文章目录爆肝五千字!ECMAScript核心概念与现代JavaScript特性全解析基本语法1
- 设计模式学习笔记 - 规范与重构 - 7.实践:通过一段ID生成器代码,学习如何发现代码质量问题
陈建111
设计模式-实战代码质量重构
前言前面讲了重构相关的知识点。用一句话总结:重构就是发现代码质量问题,并且对其进行优化的过程。今天借助一个ID生成器代码,给你展示以下重构的大致过程。背景介绍在软件开发中,ID常用来表示一些业务信息的唯一标识,比如订单的单号、数据库中的唯一主键。假设你正参与一个后端业务系统的开发,为了方便在请求出错时排查问题,在写代码的时候会在关键路径上打印日志。某个请求出错后,希望能搜索出这个请求对应的所有日志
- Pont神坑 ,添加swagger @ApiParam后无法导出参数
applebomb
javaspringmvcponttypescripptswagger
Pont是一个很好的前后端一体化工具,能够帮助自动生成API代码。今天正在整Pont的时候,发现个别API参数在pont里无法导出,经过反复的对比发现有一个神坑,很容易踩中。例如下面这个PostMapping,很习惯的,给它添加了@ApiParam参数。@PostMapping("testPost")@ApiOperation(value="后台管理员登录aaaa")publicStringtes
- 如何在Spring Boot应用中高效集成Spring Cache与Redis实现高性能缓存机制
yangqjiayou
spring缓存springboot
一、引言在现代Web应用程序开发中,缓存是一种常见的优化手段,能够显著提升系统性能,减轻数据库负载。SpringCache作为Spring框架内建的缓存抽象层,提供了一种简单易用的方式来统一处理缓存逻辑。而Redis作为一种高性能的内存键值存储系统,经常被选作SpringCache的后端存储。本文将通过一个真实的项目实例,详细介绍SpringCache的使用方法及其与Redis的集成过程。二、Sp
- 2021-12-21
ziatan
青龙openAPI非官方文档前言:之前预告发一个小工具,本来后端部分已经写完,在本地测试成功,但是搬到服务器就出现错误,再加上沉迷游戏,先鸽了。授人以鱼不如授人以渔,发个openapi使用说明,应该有人需要,其实看青龙的源码也能看明白,这里以环境变量的api为例,抛砖引玉了。官方源码:https://github.com/whyour/qinglong/blob/develop/back/api/
- 差分数组实战——滴滴春招笔试第一题
晓宜
算法python算法笔试春招实习互联网大厂
前言作者:晓宜个人简介:互联网大厂Java准入职,阿里云专家博主,csdn后端优质创作者,算法爱好者上周末参与了滴滴的春招笔试,第一题是差分数组的改版题,但是测试数据不强,听同学说暴力遍历也能过,whatever,这里分享下两种解法,顺便讲解下差分数组❤️❤️❤️你的关注是我前进的动力题目描述:小明正在模拟陨石对地质的危害。在小明的模型下,将地面从0,1,2…直到N依次从左到右进行标号。每次陨石i
- C后端开发,记录一个关于条件变量的死锁bug
若亦_Royi
开发过程中的记录C++算法bug算法c++c语言
过程前几天使用IPC进程通信的原理写了一个聊天室,并且支持高并发。在对于预防共享内存被多个进程同时使用导致信息丢失的情况时,使用了互斥锁,在客户端的代码中,最一开始是这样的:voidsend_by_signal(){DBG("DBG:send_by_signal...\n");charbuff[MAX_NAME_LENGTH]={0};while(1){intret=scanf("%[^\n]",
- 【Docker】Jaeger 容器化部署
轻云UC
运维部署docker容器运维分布式
什么是jaeger?Jaeger是受到Dapper和OpenZipkin启发的由UberTechnologies作为开源发布的分布式跟踪系统,兼容OpenTracing以及Zipkin追踪格式,目前已成为CNCF基金会的开源项目。其前端采用React语言实现,后端采用GO语言实现,适用于进行链路追踪,分布式跟踪消息传递,分布式事务监控、问题分析、服务依赖性分析、性能优化等场景。快速运行docker
- Java后端响应出来的图片流在HTML中显示
Acmen-zym
JavajavaScriptjavajs
varlogoName=$("#materPicLogo").val();if(logoName==""){layer.msg("当前没有选择设置主图LOGO");returnfalse;}varimg='''';/***返回一个图片流到前端显示**@paramlogoName*@parammap*@paramresponse*@throwsIOException*/@RequestMapping
- tomcat基础与部署发布
暗黑小菠萝
Tomcat java web
从51cto搬家了,以后会更新在这里方便自己查看。
做项目一直用tomcat,都是配置到eclipse中使用,这几天有时间整理一下使用心得,有一些自己配置遇到的细节问题。
Tomcat:一个Servlets和JSP页面的容器,以提供网站服务。
一、Tomcat安装
安装方式:①运行.exe安装包
&n
- 网站架构发展的过程
ayaoxinchao
数据库应用服务器网站架构
1.初始阶段网站架构:应用程序、数据库、文件等资源在同一个服务器上
2.应用服务和数据服务分离:应用服务器、数据库服务器、文件服务器
3.使用缓存改善网站性能:为应用服务器提供本地缓存,但受限于应用服务器的内存容量,可以使用专门的缓存服务器,提供分布式缓存服务器架构
4.使用应用服务器集群改善网站的并发处理能力:使用负载均衡调度服务器,将来自客户端浏览器的访问请求分发到应用服务器集群中的任何
- [信息与安全]数据库的备份问题
comsci
数据库
如果你们建设的信息系统是采用中心-分支的模式,那么这里有一个问题
如果你的数据来自中心数据库,那么中心数据库如果出现故障,你的分支机构的数据如何保证安全呢?
是否应该在这种信息系统结构的基础上进行改造,容许分支机构的信息系统也备份一个中心数据库的文件呢?
&n
- 使用maven tomcat plugin插件debug关联源代码
商人shang
mavendebug查看源码tomcat-plugin
*首先需要配置好'''maven-tomcat7-plugin''',参见[[Maven开发Web项目]]的'''Tomcat'''部分。
*配置好后,在[[Eclipse]]中打开'''Debug Configurations'''界面,在'''Maven Build'''项下新建当前工程的调试。在'''Main'''选项卡中点击'''Browse Workspace...'''选择需要开发的
- 大访问量高并发
oloz
大访问量高并发
大访问量高并发的网站主要压力还是在于数据库的操作上,尽量避免频繁的请求数据库。下面简
要列出几点解决方案:
01、优化你的代码和查询语句,合理使用索引
02、使用缓存技术例如memcache、ecache将不经常变化的数据放入缓存之中
03、采用服务器集群、负载均衡分担大访问量高并发压力
04、数据读写分离
05、合理选用框架,合理架构(推荐分布式架构)。
- cache 服务器
小猪猪08
cache
Cache 即高速缓存.那么cache是怎么样提高系统性能与运行速度呢?是不是在任何情况下用cache都能提高性能?是不是cache用的越多就越好呢?我在近期开发的项目中有所体会,写下来当作总结也希望能跟大家一起探讨探讨,有错误的地方希望大家批评指正。
1.Cache 是怎么样工作的?
Cache 是分配在服务器上
- mysql存储过程
香水浓
mysql
Description:插入大量测试数据
use xmpl;
drop procedure if exists mockup_test_data_sp;
create procedure mockup_test_data_sp(
in number_of_records int
)
begin
declare cnt int;
declare name varch
- CSS的class、id、css文件名的常用命名规则
agevs
JavaScriptUI框架Ajaxcss
CSS的class、id、css文件名的常用命名规则
(一)常用的CSS命名规则
头:header
内容:content/container
尾:footer
导航:nav
侧栏:sidebar
栏目:column
页面外围控制整体布局宽度:wrapper
左右中:left right
- 全局数据源
AILIKES
javatomcatmysqljdbcJNDI
实验目的:为了研究两个项目同时访问一个全局数据源的时候是创建了一个数据源对象,还是创建了两个数据源对象。
1:将diuid和mysql驱动包(druid-1.0.2.jar和mysql-connector-java-5.1.15.jar)copy至%TOMCAT_HOME%/lib下;2:配置数据源,将JNDI在%TOMCAT_HOME%/conf/context.xml中配置好,格式如下:&l
- MYSQL的随机查询的实现方法
baalwolf
mysql
MYSQL的随机抽取实现方法。举个例子,要从tablename表中随机提取一条记录,大家一般的写法就是:SELECT * FROM tablename ORDER BY RAND() LIMIT 1。但是,后来我查了一下MYSQL的官方手册,里面针对RAND()的提示大概意思就是,在ORDER BY从句里面不能使用RAND()函数,因为这样会导致数据列被多次扫描。但是在MYSQL 3.23版本中,
- JAVA的getBytes()方法
bijian1013
javaeclipseunixOS
在Java中,String的getBytes()方法是得到一个操作系统默认的编码格式的字节数组。这个表示在不同OS下,返回的东西不一样!
String.getBytes(String decode)方法会根据指定的decode编码返回某字符串在该编码下的byte数组表示,如:
byte[] b_gbk = "
- AngularJS中操作Cookies
bijian1013
JavaScriptAngularJSCookies
如果你的应用足够大、足够复杂,那么你很快就会遇到这样一咱种情况:你需要在客户端存储一些状态信息,这些状态信息是跨session(会话)的。你可能还记得利用document.cookie接口直接操作纯文本cookie的痛苦经历。
幸运的是,这种方式已经一去不复返了,在所有现代浏览器中几乎
- [Maven学习笔记五]Maven聚合和继承特性
bit1129
maven
Maven聚合
在实际的项目中,一个项目通常会划分为多个模块,为了说明问题,以用户登陆这个小web应用为例。通常一个web应用分为三个模块:
1. 模型和数据持久化层user-core,
2. 业务逻辑层user-service以
3. web展现层user-web,
user-service依赖于user-core
user-web依赖于user-core和use
- 【JVM七】JVM知识点总结
bit1129
jvm
1. JVM运行模式
1.1 JVM运行时分为-server和-client两种模式,在32位机器上只有client模式的JVM。通常,64位的JVM默认都是使用server模式,因为server模式的JVM虽然启动慢点,但是,在运行过程,JVM会尽可能的进行优化
1.2 JVM分为三种字节码解释执行方式:mixed mode, interpret mode以及compiler
- linux下查看nginx、apache、mysql、php的编译参数
ronin47
在linux平台下的应用,最流行的莫过于nginx、apache、mysql、php几个。而这几个常用的应用,在手工编译完以后,在其他一些情况下(如:新增模块),往往想要查看当初都使用了那些参数进行的编译。这时候就可以利用以下方法查看。
1、nginx
[root@361way ~]# /App/nginx/sbin/nginx -V
nginx: nginx version: nginx/
- unity中运用Resources.Load的方法?
brotherlamp
unity视频unity资料unity自学unityunity教程
问:unity中运用Resources.Load的方法?
答:Resources.Load是unity本地动态加载资本所用的方法,也即是你想动态加载的时分才用到它,比方枪弹,特效,某些实时替换的图像什么的,主张此文件夹不要放太多东西,在打包的时分,它会独自把里边的一切东西都会集打包到一同,不论里边有没有你用的东西,所以大多数资本应该是自个建文件放置
1、unity实时替换的物体即是依据环境条件
- 线段树-入门
bylijinnan
java算法线段树
/**
* 线段树入门
* 问题:已知线段[2,5] [4,6] [0,7];求点2,4,7分别出现了多少次
* 以下代码建立的线段树用链表来保存,且树的叶子结点类似[i,i]
*
* 参考链接:http://hi.baidu.com/semluhiigubbqvq/item/be736a33a8864789f4e4ad18
* @author lijinna
- 全选与反选
chicony
全选
<!DOCTYPE HTML PUBLIC "-//W3C//DTD HTML 4.01 Transitional//EN" "http://www.w3.org/TR/html4/loose.dtd">
<html>
<head>
<title>全选与反选</title>
- vim一些简单记录
chenchao051
vim
mac在/usr/share/vim/vimrc linux在/etc/vimrc
1、问:后退键不能删除数据,不能往后退怎么办?
答:在vimrc中加入set backspace=2
2、问:如何控制tab键的缩进?
答:在vimrc中加入set tabstop=4 (任何
- Sublime Text 快捷键
daizj
快捷键sublime
[size=large][/size]Sublime Text快捷键:Ctrl+Shift+P:打开命令面板Ctrl+P:搜索项目中的文件Ctrl+G:跳转到第几行Ctrl+W:关闭当前打开文件Ctrl+Shift+W:关闭所有打开文件Ctrl+Shift+V:粘贴并格式化Ctrl+D:选择单词,重复可增加选择下一个相同的单词Ctrl+L:选择行,重复可依次增加选择下一行Ctrl+Shift+L:
- php 引用(&)详解
dcj3sjt126com
PHP
在PHP 中引用的意思是:不同的名字访问同一个变量内容. 与C语言中的指针是有差别的.C语言中的指针里面存储的是变量的内容在内存中存放的地址 变量的引用 PHP 的引用允许你用两个变量来指向同一个内容 复制代码代码如下:
<?
$a="ABC";
$b =&$a;
echo
- SVN中trunk,branches,tags用法详解
dcj3sjt126com
SVN
Subversion有一个很标准的目录结构,是这样的。比如项目是proj,svn地址为svn://proj/,那么标准的svn布局是svn://proj/|+-trunk+-branches+-tags这是一个标准的布局,trunk为主开发目录,branches为分支开发目录,tags为tag存档目录(不允许修改)。但是具体这几个目录应该如何使用,svn并没有明确的规范,更多的还是用户自己的习惯。
- 对软件设计的思考
e200702084
设计模式数据结构算法ssh活动
软件设计的宏观与微观
软件开发是一种高智商的开发活动。一个优秀的软件设计人员不仅要从宏观上把握软件之间的开发,也要从微观上把握软件之间的开发。宏观上,可以应用面向对象设计,采用流行的SSH架构,采用web层,业务逻辑层,持久层分层架构。采用设计模式提供系统的健壮性和可维护性。微观上,对于一个类,甚至方法的调用,从计算机的角度模拟程序的运行情况。了解内存分配,参数传
- 同步、异步、阻塞、非阻塞
geeksun
非阻塞
同步、异步、阻塞、非阻塞这几个概念有时有点混淆,在此文试图解释一下。
同步:发出方法调用后,当没有返回结果,当前线程会一直在等待(阻塞)状态。
场景:打电话,营业厅窗口办业务、B/S架构的http请求-响应模式。
异步:方法调用后不立即返回结果,调用结果通过状态、通知或回调通知方法调用者或接收者。异步方法调用后,当前线程不会阻塞,会继续执行其他任务。
实现:
- Reverse SSH Tunnel 反向打洞實錄
hongtoushizi
ssh
實際的操作步驟:
# 首先,在客戶那理的機器下指令連回我們自己的 Server,並設定自己 Server 上的 12345 port 會對應到幾器上的 SSH port
ssh -NfR 12345:localhost:22
[email protected]
# 然後在 myhost 的機器上連自己的 12345 port,就可以連回在客戶那的機器
ssh localhost -p 1
- Hibernate中的缓存
Josh_Persistence
一级缓存Hiberante缓存查询缓存二级缓存
Hibernate中的缓存
一、Hiberante中常见的三大缓存:一级缓存,二级缓存和查询缓存。
Hibernate中提供了两级Cache,第一级别的缓存是Session级别的缓存,它是属于事务范围的缓存。这一级别的缓存是由hibernate管理的,一般情况下无需进行干预;第二级别的缓存是SessionFactory级别的缓存,它是属于进程范围或群集范围的缓存。这一级别的缓存
- 对象关系行为模式之延迟加载
home198979
PHP架构延迟加载
形象化设计模式实战 HELLO!架构
一、概念
Lazy Load:一个对象,它虽然不包含所需要的所有数据,但是知道怎么获取这些数据。
延迟加载貌似很简单,就是在数据需要时再从数据库获取,减少数据库的消耗。但这其中还是有不少技巧的。
二、实现延迟加载
实现Lazy Load主要有四种方法:延迟初始化、虚
- xml 验证
pengfeicao521
xmlxml解析
有些字符,xml不能识别,用jdom或者dom4j解析的时候就报错
public static void testPattern() {
// 含有非法字符的串
String str = "Jamey친ÑԂ
- div设置半透明效果
spjich
css半透明
为div设置如下样式:
div{filter:alpha(Opacity=80);-moz-opacity:0.5;opacity: 0.5;}
说明:
1、filter:对win IE设置半透明滤镜效果,filter:alpha(Opacity=80)代表该对象80%半透明,火狐浏览器不认2、-moz-opaci
- 你真的了解单例模式么?
w574240966
java单例设计模式jvm
单例模式,很多初学者认为单例模式很简单,并且认为自己已经掌握了这种设计模式。但事实上,你真的了解单例模式了么。
一,单例模式的5中写法。(回字的四种写法,哈哈。)
1,懒汉式
(1)线程不安全的懒汉式
public cla